全球147種疫苗火熱開發中 18種進臨床
新冠肺炎疫情肆虐全球,世界各國都想搶先一步開發出疫苗。但疫苗戰不只比資金,還攸關技術及國家安全,到底誰能獲得最後勝利,成功開發出疫苗呢?
譯者‧江裕真

▲美國啟動「神速行動」計畫,為的就是搶先開發出新冠疫苗。圖為美國國家衛生院院長法蘭西斯.柯林斯。
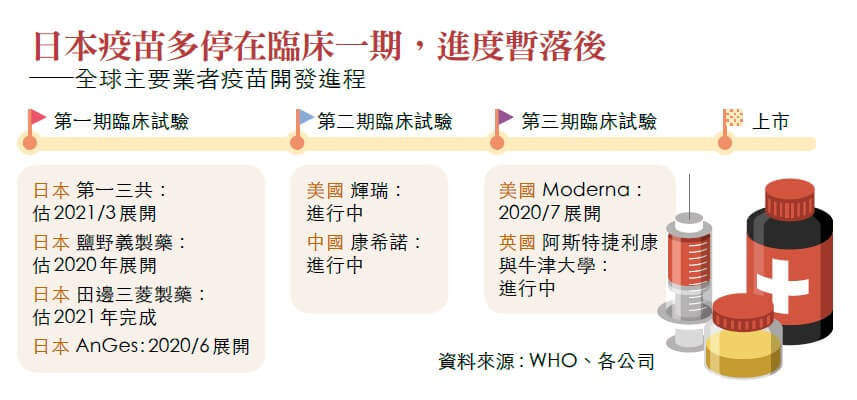
新冠肺炎疫情方興未艾,要想全面重啟經濟,就少不了疫苗。根據世界衛生組織(WHO)在七月二日時的資料,全球一四七種開發中的疫苗,已有十八種進入人體臨床試驗。
疫苗的開發以歐美與中國為中心,各國都彼此較勁,看誰最能保護國民免受病毒侵襲。在疫苗開發競賽中,最領先的美國於五月發表「神速行動」計畫,除衛生部與疫管中心外,國防部也參與其中。該計畫已確保百億美元預算,準備在二○二一年一月之前,取得有效又安全的三億份疫苗。
當局先是選定五款最看好的疫苗,其中英國的阿斯特捷利康(Astra Zeneca )與牛津大學共同開發的疫苗,已獲十二億美元援助,而美國嬌生與美國生技新創公司Moderna,也分別獲得五億美元的援助。
為國安 須自行掌控疫苗
疫苗的開發,一般是由製藥公司包辦研發到生產,因此為把風險降到最低,都會視開發進程,再階段性補強生產設備;但這次因為疫情緊急,開發時就已投入龐大資金強化生產設備,以大幅縮短進入量產的時間。
該計畫援助的疫苗, 都各自採用不同的技術與施打方式,這可以避免雷同的選項最後全都失敗。但換句話說,一旦其中一種疫苗開發成功,其他的投資很可能就白費了。
歐盟也有動作,已經從盟國集資一六○億歐元,用於開發疫苗與治療藥物,也已宣布斥資二十四億歐元購買疫苗。中國也持續由大型生技新創公司與大學等國營研究機構,聯手開發多種疫苗,緊跟領先群。
傾全國之力援助企業開發,除了著眼於盡早重啟經濟之外,「也是因為能否自行掌控疫苗,涉及到國安問題。」東京大學醫療科學研究所疫苗科學領域教授石井健說。他曾在美國食品藥品監督管理局(FDA)負責疫苗研究與臨床試驗審查,「美國的疫苗開發與生產,都會把因應生化恐攻考量在內。」這也是國防部參與的原因所在。
各國都致力於爭奪與拉攏優質疫苗開發企業,美國援助英商阿斯特捷利康時,已經說好在進入生產階段後,要供應三億份疫苗給美國。法商賽諾菲(Sanofi)在五月中旬接受美國當局援助時,執行長保羅.哈德森(Paul Hudson)也曾表示,一旦開發成功,要優先供應美國,但因為法國國內的批判聲量變高,遂撤回該發言。
此外,德國投資國內生技新創公司CureVac三億歐元,取得二三%的股份,該公司正進行第一期臨床試驗。三月時曾有報導說,美國正盤算拉攏這家公司。
至於日本,也一樣以本國為優先;只是,日本國內疫苗的開發狀況,卻令人擔心。
目前日本進度最超前的是生技新創公司AnGes與大阪大學等單位共同開發的基因疫苗,六月三十日已率先展開人體臨床試驗。七月底預計結束第一期臨床試驗,進入大規模臨床試驗,順利的話,明年春天前後可望上市。
「日本在開發競賽的階段,無疑是領先群之一;但就算開發成功,到了生產階段,應該仍會追不上美、中與歐洲。」石井說。
AnGes在開發階段就同時確保生產能力,與寶生物公司(Takara Bio)聯手,目標是今年內先確保生產二十萬份疫苗,明年三月前至少確保百萬份疫苗。
在政府於六月十二日通過的第二次修正預算中,援助疫苗生產的預算共一三七七億日圓,但和歐美比起來,還是很少。
技術、市場評價 都是考驗
全球疫苗市場以英國葛蘭素史克為首,四家歐美大廠占去約八成。疫苗不同於一般藥品,不會因專利過期就失效,新來的業者必須耗費開發成本,先針對市面產品做同樣的研究,進入門檻很高;因此業者在不斷整併後,漸漸形成大型業者的寡占。
「之前沒有積極進軍海外的國內廠商,到頭來只能巴著小規模的國內市場。」一位經手疫苗的外資廠商相關人士說。疫苗的生產要看知識、經驗與技術,不是導入設備就能一夕量產。
AnGes創辦人暨大阪大學教授森下龍一也說,「不同於美國,沒人保證疫苗能夠全被買單。在不清楚投資能否回收的情形下,難以大舉擴充產能,也是無可奈何。」
六月二十六日,藥商「第一三共」宣布,已經開始和阿斯特捷利康洽商供應疫苗給國內。一旦對方開發成功,將會購買疫苗原液製劑,但供應的時點還沒確定。前述外資人士說,「日本對疫苗安全與否尤其敏感,之前就有因害怕坊間對安全性的過度批判導致產品汙名化,而等到海外認可後才在日本流通的例子。」
疫苗現階段雖然著眼於開發,但今後須將焦點放在「確保生產能力」上。
閱讀完整內容
本文摘錄自
歐美中衝刺、日急追 疫苗大戰誰勝出
今周刊
2020/第1232期
相關