解密最新CRISPR基因療法 癌症、罕病有救了
每五分鐘就有一個台灣人罹癌,全台更有一萬五千名罕病患者,活在無藥可治的痛苦中。如今,出現了可望「根治」諸多遺傳性疾病的夢幻療法。
去年底,美國正式批准第一款基因療法上路;今年初,最革命性的基因編輯技術CRISPR,展開首批臨床試驗;台灣也有數十位參與基因療法實驗的患者,已獲得驚人的療效。最新的技術,還能自由改寫人體兩萬個基因。
為何修改基因缺陷,可以變得像剪貼一般容易?基因編輯過後,會不會出現意想不到的新風險?市場規模上看140兆台幣的基因療法,是否會淪為有錢人才能負擔的玩意?
台大兒童醫院地下一樓的咖啡店,快滿五歲的健健(化名)正等待上復健課。
他明顯較同齡小孩瘦弱,坐在嬰兒車裡,不時好奇地四處觀望,同時不斷把一隻腳踢向空中。
他的媽媽佳穎(化名)坐在一旁說,「我很幸運,因為我知道其他家長的遭遇,有些孩子甚至吃了一年的抗癲癇藥,一直找醫生、一直換,就是找不到病因。」
健健出生滿六個月時,還不會自己翻身,全身軟癱、鬥雞眼,還會不定期全身抽搐,每週發作至少兩次,每次四到六個小時。
心急如焚的佳穎,帶著健健看了三個醫生,從小診所看到馬偕醫院的腦神經外科,都找不出明確病因,反而更加惶恐。
擁有名校法學碩士學位的她,也只能辭掉高薪工作,專心照料健健。
直到一次感冒,醫生門診時發現,當時七個月大的健健,脖子軟軟的,一點力氣都沒有,「就算是發展遲緩,也不會這麼遲緩,」那位醫生覺得事有蹊蹺,轉介給馬偕罕病中心主任林炫沛,他也是罕病基金會董事長。
健健確診為遺傳性罕見疾病「AADC缺乏症」。錯愕的佳穎,當時腦中一片空白,只能請林炫沛把這四個英文字母寫在紙上。出了醫院,才開始研究這到底是什麼病?
AADC(芳香族L‒胺基酸脫羧酵素)缺乏症,來自先天性基因缺陷,無法合成負責腦內傳遞訊號的多巴胺等多種人體必需的化學物質。
除了類似癲癇的發作症狀,AADC不足所引發的全身僵硬、肢體顫抖等症狀,和帕金森氏症相似。患者平均壽命只有五到六歲。
許多與健健類似病情的小孩,甚至在睡夢中就無聲無息地逝世。
但在健健兩歲那年,他的命運迎來急轉彎。獲准加入台灣第一個基因療法臨床試驗──台大醫院
AADC基因療法試驗的他,此時動了手術。
改變命運的契機──罕病兒有救了!
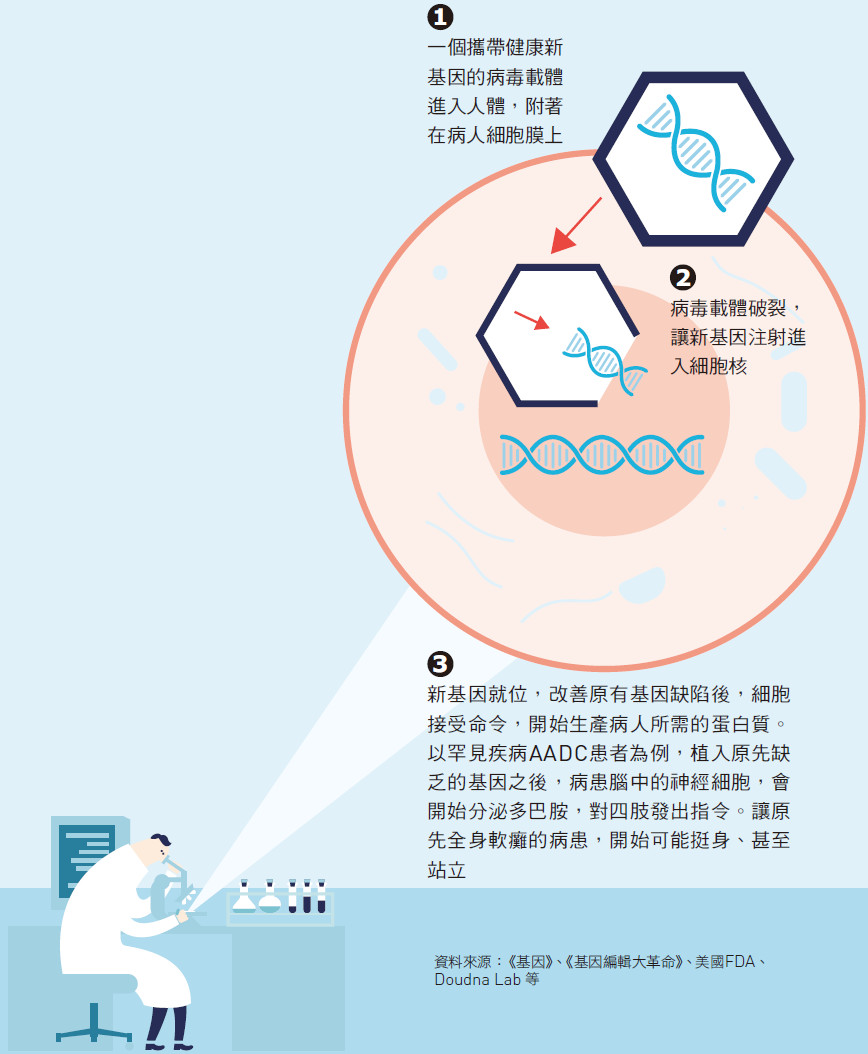
療法的概念很簡單,將健健所缺乏的基因,用病毒載體攜入他的腦部細胞,健健的身體就會生產原先缺乏的化學物質,像正常人一樣。
但真正執行起來,卻是一個長達十二小時的高難度手術,要將大量病毒注射到一個兩歲小孩大腦深處的殼核部位,「這是很複雜的事情,」一位參與手術的台大醫院醫師說。
AADC缺乏症是個很有「台灣味」的罕見疾病。目前為止,全球確診人數約一三○人,台灣就佔了四十四位,將近總數的三分之一。
健健的主治醫師,台大醫院小兒部暨基因醫學部教授胡務亮團隊,加上日本自治醫科大學、美國佛羅里達大學基因治療研究中心的跨國合作,以及張榮發基金會的資助,開啟了全球第一個AADC基因療法,可能也是當前全世界最成功的腦部基因療法。
術後經過近三年復健,健健症狀大為改善,慢慢可以自己翻身、坐著,不過還是會抽搐,語言和行走能力,也還沒能完全恢復。
台大醫院遺傳諮詢師李美欣表示,台大的基因療法才發展八年,健健究竟能恢復到什麼程度?醫學也沒有先例,「有些東西在臨床要追個十幾、二十年,我們就是小心謹慎地在走,」她說。
醫學革命的最前線──基因療法,首度上市
包括健健在內,參與台大、中國醫藥大學等全台灣共三個基因治療臨床試驗(見62頁表4)的數十個罕病、癌症重症病患,正站在一場醫療革命的最前沿。
基因療法,就是將正常基因送入人體細胞,以改變其遺傳缺陷、恢復人體正常運作的創新療法。
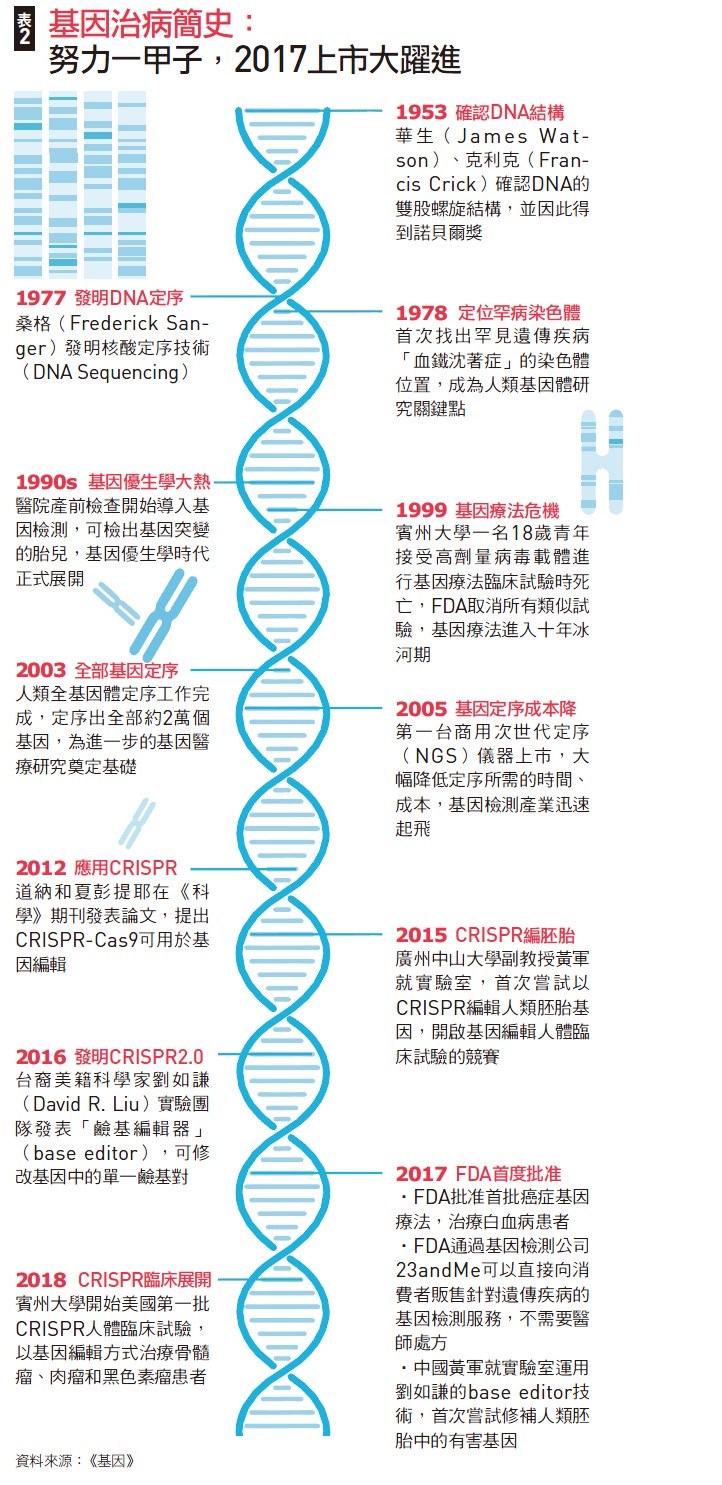
打從一九五三年華生與克利克發現DNA雙螺旋結構以來,這個能真正「根治」諸多遺傳性疾病的夢幻療法,一直是諸多科學家、醫學研究者追求的科學聖杯。(見55頁表2)
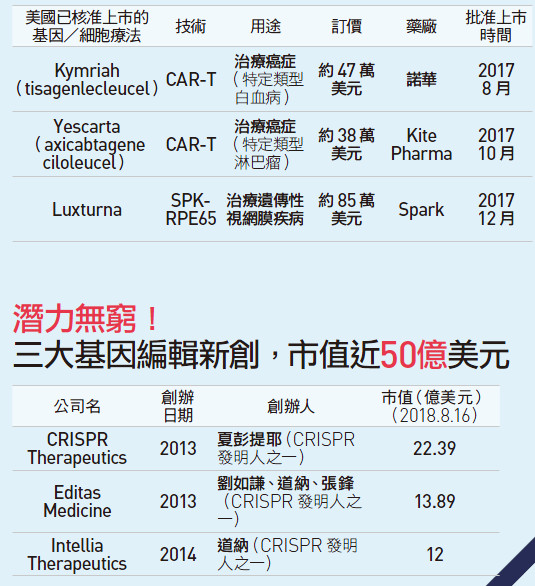
二○一七年十二月,美國食品藥品管理局(FDA)終於許可歷史上第一個基因療法Luxturna上市,宣告新時代開始。
該療法是針對另一種罕見疾病,稱為LCA的一種遺傳性視網膜病變。此外,還有針對脊髓性肌肉萎縮症(SMA)、白血病等多種疾病的基因療法正在臨床試驗,可望在今、明年陸續上市。
對生技醫藥產業而言,是數十年一遇的產業變革。
大藥廠迅速動起來,光是一七至今,短短一年多時間,就出現三起針對基因療法的千億台幣等級大併購,合計金額高達二九六億美元。(見54頁表1)
中小型併購更是難以計數,其中一個更與台灣,以及健健息息相關。
【表3】140兆大商機!基因治病有多神?
高盛今年4月發布研究報告「基因體革命」(The Genome Revolution),指出,基因治療的市場未來可達一年4.8兆美元(約140兆台幣),遠高於製藥產業,「因為基因是所有生物活動的基礎,」高盛分析師里克特(Salveen Richter)寫道。
天價醫療!
治一個人要花85萬美元
高盛報告將革命性的基因醫藥技術,分為:基因療法、基改細胞療法以及基因編輯三種。其中最具革命性的CRISPR基因編輯技術,才剛進入人體試驗。
以CAR-T技術為主的基改細胞療法,至今已有兩款經美國FDA核准上市。而去年12月FDA批准的世界第一款基因療法Luxturna ,一度傳出將訂價100萬美元,轟動一時。最後雖然打了85折(約2550萬台幣),對多數患者而言依舊高不可攀。
快問快答:
基因編輯新技術CRISPR全解析
ⓆCRISPR為何爆紅?
ⒶCRISPR(Clustered Regularly Interspaced Short Palindromic Repeats),是一種新的基因編輯技術。目前又以運用蛋白質Cas9的方式為主流,稱為CRISPRCas9,2012年由加州大學柏克萊分校教授道納和法國細菌學者夏彭提耶發表。
CRISPR並非第一個基因編輯技術,引起產學界震撼的主因是該技術遠比傳統方法簡單、快速且便宜,而且不像以往的基因編輯法一次只能修改一個,CRISPR可以一次有效、精準地修改多組基因,從此讓修改生物基因,如同修正一段文字的錯字一般方便。
ⓆCRISPR技術可以用在哪裡?解決什麼問題?
ⒶCRISPR技術可以修改任何生物的基因。因為不像傳統的
基改(GMO)技術,有引進外來基因問題。因此CRISPR已廣泛應用在農漁牧業,例如:養殖時間減半的基改鮭魚、無法傳播瘧疾的蚊子、抗蟲害作物,或是果肉不會變褐色的蘋果等。CRISPR也將用在人體,用途分成兩種:治病與追求完美。
前者用來治療超過7000種遺傳性疾病,如鐮形血球貧血症、乙型地中海型貧血、SCID(嚴重複合型免疫缺乏症),或癌症、亨丁頓舞蹈症、AIDS、肌肉萎縮症等。
後者則透過修改基因,可改變膚色、外貌,體能甚至於智力,打造出心目中的完美寶寶。
Ⓠ用CRISPR為人類治病,主要的障礙為何?
Ⓐ今年6、7月,著名期刊《自然醫學》、《自然生物科技》分別刊出論文,表示CRISPR-Cas9基因編輯療法用在人體,因難以精確切割基因,可能造成其他意想不到的基因損害,恐將導致某些細胞發生危險變化,有致癌的危險性。結果造成相關類股大跌。
不過包括提出CRISPR編輯功能的道納團隊在內,多數學者認為,隨著新版本的CRISPR技術不斷改善準確度,便可解決副作用問題。
圖解基因治療:
壞掉的基因,怎麼替換?
簡單來說,基因療法就是把一個新的基因,放到病人的細胞中,藉此替換功能異常或者消失的基因。
研究人員一般是利用病毒來攜帶這些遺傳物質進入細胞。早期是利用腺病毒(一般感冒病毒的變種),但是它會啟動身體的免疫反應,引發嚴重副作用,現今多採用不會導致人類疾病的「腺相關病毒」。
大革命帶來大商機──市場規模上看140兆台幣
七月十九日,美國上市生醫公司PTC宣布以兩億美元頭期款收購基因療法新創公司艾吉里斯(Agilis Biotherapeutics)。最後收購金額可能接近十億美元。
▲基因治療的潛在商機上看140兆台幣,吸引許多大企業和新創躍躍欲試。
在PTC收購艾吉里斯的分析師會議報告,該公司指出艾吉里斯最具潛力且進度最快的新基因療法,正是由台大技轉給該公司的AADC基因療法——GTAADC。
艾吉里斯表示,該公司與台大合作,在台灣進行的三期AADC臨床實驗,共有二十六個重症病患受試。胡務亮以衛生署要求臨床試驗保密為由,拒絕與《天下》談論相關資訊。
但在艾吉里斯於一七年九月發布的新聞稿,胡務亮以該試驗總主持人的身分指出,接受治療的兒童運動能力有「重要進展」。「部份小孩可以維持頭部位置、不靠外力坐定,靠協助站立。這些都是不靠治療絕對達不到的重要里程碑。」
在PTC的分析師會議,還播放出台大病患腦部的正子造影圖片,顯示術後五年,多巴胺分泌大增。PTC執行長皮爾茲(Stuart Peltz)接著播放短片,顯示一個清秀的台灣小男孩病患(不是健健),從本來動彈不得,術後一年可跪著跟媽媽嬉戲,三十個月後,更可緩慢走路。
「這很令人印象深刻,所以你們可以理解,為什麼我們這麼渴望將這個療法盡快帶給患者,計劃二○一九年提出生物製劑藥品上市申請(BLA),」皮爾茲說。
今年四月十日,高盛生技產業分析師里克特(Salveen Richter)發出一篇關於基因療法的大型報告:「基因體革命」(The Genome Revolution)。她分析,基因治療的市場規模上看一年四.八兆美元(約一四○兆台幣),「因為基因是所有生物活動的基礎。」
產業界對基因療法期待如此之高,因為治療罕病,只是基因療法的牛刀小試;接下來更可望擴展到人類最普遍的絕症——「萬病之王」癌症。
連傳統對新療法態度最保守的美國FDA,局長葛利亞伯(Scott Gottlieb)今年五月都在一場演講這樣說,「長久以來,基因和細胞療法只是理論,但現在卻成為臨床治療的現實。我期盼,他們很快就會成為我們治療各種疾病的主流。」
美國麻省理工學院(MIT)在一份報告中預測,FDA可望在二○二二年底前通過四十項基因療法產品,其中四五%將用於癌症治療。
「現在有好幾百個人體不同器官的臨床實驗正在進行。我們身處在基因療法最廣泛、最令人興奮的時代,」以《基因》登上《紐約時報》暢銷書榜首,美國哥倫比亞大學醫學中心癌症醫師穆克吉(Siddhartha Mukherjee)接受《天下》電話專訪時也興奮地說。
比以前便宜、快一百倍──基因編輯界的巨星CRISPR
高盛報告列出主導基因治療的三大技術變革:
第一種,是前述治療罕見疾病的狹義基因治療。
第二種,是基改癌症治療。也就是以人體T細胞去攻擊腫瘤,目前已有兩項療程上市。(見57頁)
而第三種新技術,則是基因編輯(gene editing)。意思是,可以自由改寫人體兩萬多個基因,就像編輯一篇文章的一小段落,或者修改一段程式碼一樣簡單。
說的正是當前全球生命科學領域紅遍半邊天的明星技術——CRISPR。
CRISPR六個英文字母,指的是細菌基因體裡的特殊結構:「群聚且有規律間隔的短回文重複序列。」拗口的文字背後,是微生物學家八○年代在大腸桿菌的基因體裡發現,有許多固定又重複的片段。
一二年七月,加州大學柏克萊分校教授道納(Jennifer Doudna)和法國細菌學者夏彭提耶(Emmanuelle Charpentier)在《科學》上發表的論文,說明如何用蛋白質Cas9鎖定一段DNA雙股螺旋,解開並切割其中片段,讓基因編輯技術CRISPR更加簡便。
中研院生化所助研究員凌嘉鴻加入道納的實驗室,親身體驗這把「DNA剪刀」的威力,就是在論文發表的兩個月後。
「我剛好一開始就趕上那個列車,我們都說好像在坐雲霄飛車,」博士班畢業後,從微生物系轉進基因編輯領域的凌嘉鴻,正好站在CRISPR的浪尖。
不到半年,東岸的麻省理工學院教授張鋒也發表論文,說明運用Cas9的CRISPR技術(CRISPRCas9),在動植物與人類細胞上的應用潛力。
道納和夏彭提耶的論文,破解了這把DNA剪刀的設計、功能、使用方式;張鋒的發現,則是開啟了剪刀的市場與通路。
相較過去的基因編輯工具——類轉錄活化因子核酸酶(TALEN)或鋅指核酸酶(ZFN),CRISPRCas9最大的賣點,就是低成本和簡易的操作。從花費的時間成本來看,可差到一百倍。

▲加州大學柏克萊分校分子暨細胞生物學系和化學系教授道納的研究團隊,成功破解CRISPR-Cas9的「剪刀」架構。(GettyImages 提供)
「真的很簡單,我今天可以抓一個國高中生,只要稍微懂一點生物學,就可以教他做了,」凌嘉鴻說。
CRISPR臨床應用正在萌芽,但CRISPR概念股已經紅遍美國新創圈。
運用CRISPR-Cas9技術成立的三大新創公司——CRISPR Therapeutics、Editas Medicine、Intellia Therapeutics,都已是市值超過十億美元的上市企業。(見57頁)
這個操縱生命密碼的神奇技術,讓非生醫領域的科技業人士,都興奮地想湊熱鬧。
比爾蓋茲是一例,他的比爾蓋茲基金會大力贊助CRISPR相關研究。他在今年五/六月號的《外交事務》期刊裡撰寫專文指出,「未來十年,基因編輯可以幫助人類克服全球健康與發展,幾個最大、歷史最悠久的挑戰。」
前臉書總裁帕克(SeanParker),這位在電影《社群網戰》由搖滾歌手賈斯汀飾演的明星科技富豪,更大手筆贊助美國第一個CRISPR人體試驗。
基本上,這可以算是前述基改癌症療法的改進版。
賓州大學十八個惡性肉瘤、惡性黑色素瘤患者,將取出血液中的T細胞,用CRISPR技術刪除細胞兩個基因,這些T細胞便搖身一變,成為精準的腫瘤殺手,在病人體內大開殺戒。
該試驗已通過FDA的許可,預期將在今年展開。
只不過,這雖是已開發國家第一個CRISPR臨床試驗,卻不是世界第一。
加州大學柏克萊分校分子暨細胞生物學系和化學系教授道納的研究團隊,成功破解CRISPR-Cas9的「剪刀」架構。(GettyImages 提供)
▲MIT神經科學家張鋒不只開啟了CRISPR的廣泛應用,也正在著手改善,升級CRISPR2.0。(達志影像/美聯社提供)
中國搶在美國之前──CRISPR進化,演成中美新戰局
早在去年三月,中國一家在海外默默無聞的地區醫院,杭州腫瘤醫院院長吳式琇,就已將與賓州大學類似的基改癌症療法,應用在食道癌患者身上。
美國《華爾街日報》記者到杭州採訪,發現相對於美國對於人體基因治療的嚴格審查與重重關卡。中國極為寬鬆,「實際上,院方只在一天下午,花了半小時就批准吳式琇的研究。」
而且,截至一八年二月,中國已有九件登記有案的CRISPR臨床試驗,從癌症到愛滋治療都有。而美國只有賓州這一起。
賓州大學CRISPR研究團隊首席科學家朱恩(Carl June)指出,在CRISPR醫療應用領域,中國可能已經超過美國,「美國處於一個危險的位置,可能失去生物醫藥的領先地位,」他對《華爾街日報》說。
不過僅僅六年,超高速發展之下,CRISPR已廣泛應用在動植物及人類醫療,而且,也開始發現該技術在人體的副作用。
今年六月,《自然醫學》刊出的兩篇論文顯示,CRISPR-Cas9 剪切DNA的動作會啟動細胞裡的守門員p53,而影響DNA修復機制,甚至將細胞導向死亡。雖然在實驗中關掉p53有助提升基因編輯的成效,但矛盾的是,少了p53的把關,就難以防止因為DNA編輯而意外造成的細胞變異,甚至有癌化的可能。
打開潘朵拉的盒子──編輯過的基因,風險難料?
消息傳出,三大CRISPR新創企業股價,分別大跌兩到三成。幸好,也同樣高速發展的基礎研究領域,已適時產出可以解決副作用的進階版技術——鹼基編輯器(Base Editor),被譽為CRISPR2.0。
如果第一代使用Cas9酵素的CRISPR技術是剪刀,鹼基編輯器就像是「鉛筆與橡皮擦」。
「因為剪刀只負責剪,可是修復這件事,決定權在細胞。細胞愛用的修復機制,容易造成隨機變化,是你沒辦法控制的,」凌嘉鴻說,就是這個修復機制,容易造成副作用。
鹼基編輯器就選擇避開DNA雙股螺旋的切割,而是把ATCG四個鹼基裡的A、T鹼基擦掉,直接改寫成G、C鹼基。
催生鹼基編輯器的,就是哈佛教授、台裔美籍科學家劉如謙。他是「CRISPR2.0」世界中的教父級人物,更因此被權威的《自然》期刊,選為一七年年度十大科學家。(見72頁)
諷刺的是,第一個將CRISPR2.0投入醫學應用的,一樣是中國科學家。這回,是年僅三十多歲的廣州中山大學生命科學院副院長黃軍就。
劉如謙關於「鹼基編輯器」的關鍵論文發表不到半年,黃軍就團隊便快速在一七年十月,發表首度在人類胚胎驗證該技術的論文。該團隊成功編輯人體胚胎基因組,去除乙型地中海貧血的致病基因。
「中國速度」令人嘆為觀止,該研究更開拓未來直接從胚胎修改基因突變,或者遺傳性疾病的可能性。
慧智基因執行長,也是婦產科名醫的蘇怡寧表示,現在孕婦做胚胎基因檢測,發現遺傳缺陷時,可能選擇不留下胚胎,未來可能直接用CRISPR修改,再放回子宮。變成「檢測、修改基因一條龍」,「但起碼要五到十年後,不會這麼快,」他說。
也就是說,類似健健一樣的遺傳性罕病患者,未來可能在出生前就接受「基因治療」,讓他像常人一般健康活潑地成長。
這也不免令人好奇,既然可修改人體的「原始碼錯誤」,那可以進一步修改,生出更聰明、更美麗、更高大強壯的「訂製嬰兒」嗎?
答案是:還早!
▲知名影星安潔莉納裘莉發現自己有乳癌致病基因時,在40歲之前做預防性切除,割掉乳房、卵巢與輸卵管,轟動一時。未來對應乳癌致病基因的基因療法問市,裘莉或許不需如此犧牲,也能遠離癌症陰影。(AFP提供)
社會衝擊與倫理試煉──富人的玩意?親情的考驗?
一位基因醫學教授解釋,醫學界對基因了解還很粗淺,「我們對疾病的知識較清楚。但我們不知道什麼叫漂亮、聰明、高個子的基因。只能排除嚴重疾病,沒辦法挑選優秀品種。」
而且在「訂製嬰兒」、「改造人」衝擊人類對生命倫理的思考之前,即將在未來幾年蜂擁上市的第一波基因療法,將因奇蹟般的療效與高昂的價格,帶來第一波社會衝擊。
今年初,第一個拿到美國FDA核准的基因療法產品Luxturna,定價八十五萬美元(約二五五○萬台幣)。Luxturna是用來治療稱為LCA的遺傳性視網膜病變,針對單一基因位置RPE65做治療。
LCA屬於俗稱夜盲症的遺傳性視網膜病變其中一種,現在無藥可治。失明患者只能裝上美國進口的電子眼,在眼睛植入晶片,將光線訊號傳給視覺神經。
台中榮總視網膜科主任醫師林耿弘表示,LCA是夜盲症中最早發病的,患者多屬幼兒,因為還在發育,基因治療後也比較容易恢復視力。
要花兩千多萬,一般人半輩子都賺不到的高昂代價,讓小孩看見色彩、看見世界,有多少家長願意?
「我認為台灣多數人不願意付這個錢,」林耿弘說。
但視網膜衰退不會致命。未來一系列對抗罕病、癌症等絕症的基因療法,因高昂研發成本,目前研擬中的訂價,都從數十萬美元起跳,甚至超過百萬美元。
健健所接受的AADC基因療法,未來一旦離開臨床,在台灣上市,訂價很可能超過千萬元台幣。
很多家長勢必面臨親情與金錢的全新掙扎。
基因療法的上市,是許多病患渴求已久的希望,卻也帶來全新的問題與挑戰。(本文由中研院生化所助研究員凌嘉鴻協助審訂科學內容)
【表4】基因醫學服務:台灣民眾有哪些資源可運用?
基因檢測有4種
目前國內的基因檢測相關公司,如慧智基因、基龍米克斯、行動基因、麗寶生醫、創源生技、亞大基因等約30家,部份與台大、榮總、彰基等醫療院所合作。服務項目大致可分為基因定序資料分析、孕婦/新生兒檢測、罕見疾病及癌症篩檢。
基因檢測在國內並非健保項目,檢測的價格依不同疾病有所不同,約從千元到幾十萬元不等。
例如台大的NGS(次世代定序)檢測、榮總與麗寶生醫的癌症標靶用藥基因檢測,皆為三萬元。
①基因定序資料分析
人體的基因檢測,可以針對單一癌症/疾病基因檢測,了解自己是否有致病基因;也可以透過人類全基因體定序(Whole Genome Sequencing)來檢測所有的基因。但檢測後的資料需要專業公司、醫師進行分析及解說。
②孕婦/新生兒檢測
孕前檢測、孕期間的疾病檢測如肌肉萎縮、唐氏症、癲癇等;新生兒如聽損基因、異位性皮膚炎過敏基因檢測等。
③罕見疾病檢測
有超過220項檢測,包含小胖威利症、白化症等。
④癌症篩檢
檢測如大腸直腸癌、乳癌、肺癌等超過400個以上的癌症基因、35種以上標靶用藥基因。
不過,基因治療還在臨床實驗階段⋯⋯
基因治療目前尚未在台灣上市,但有3個正在進行的基因治療人體臨床試驗:
①台大醫院內科部吳明賢醫師:轉移性胰臟癌
②台大醫院基因醫學部胡務亮團隊:芳香族L-胺基酸脫羧酵素(AADC)缺乏症
③中國醫藥大學附設醫院周德陽團隊:膠質母細胞瘤
閱讀完整內容
本文摘錄自
癌症、罕病有救了
天下雜誌
2018/9月號第655期
相關